中国药监局加入ICH后,一系列ICH指南文件落地实施,制药行业深深感受到了变革之巨大。药物警戒无疑是与国际标准存在明显差异的领域。
在欧美日等ICH国家中,药物警戒是保障药品长期存在的必要条件,为药品的安全合理使用,企业的平安健康发展保驾护航。做不好药物警戒工作,持有人可能面临巨额罚款和惩罚性赔偿,药物警戒负责人甚至会面临牢狱之灾。药物警戒职能被公司高度重视,药物警戒部门更是被视为产品的”风控部门“,“情报中心”,“神盾局”。
在今天的中国,无论是老牌企业还是创新药企业,在开展国际事务时,都必须把满足药物警戒法规要求当成一门必修课。体系的建立、人员能力的培养、意识的强化等都是药物警戒工作的重点。短期依靠外包,长期自建团队成为了众多企业共同的选择。当下,运用信息化系统管理药物警戒工作,已经成为了主流和常规操作,药物警戒系统能够能否满足当地法规要求至关重要。
国内首家太美医疗科技eSafety系统成功对接欧盟EudraVigilance 数据库中国药物警戒里程碑
继通过FDA AERS(FAERS)系统E2B电子递交测试后,2019年5月6日,太美医疗科技eSafety药物警戒系统再次成功接轨境外监管机构数据库,与EudraVigilance数据库顺利完成ICH E2B R3的对接测试,并成为中国首个成功对接EudraVigilance数据库的药物警戒系统,对于中国药物警戒事业发展具有里程碑式的意义。
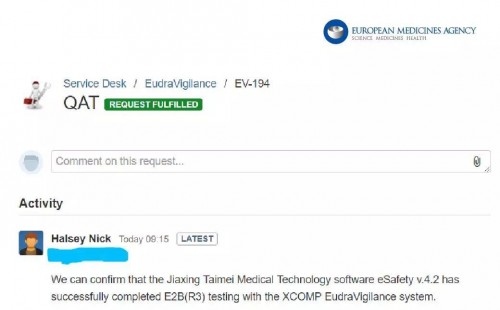
至此,ICH三大成员国和区域中,eSafety药物警戒系统 已完成与两大区域的监管机构E2B电子递交的对接测试,与日本和加拿大等国的对接也在积极进行中。
EudraVigilance是管理和分析欧洲经济区(EEA)临床研究阶段和上市后的药物疑似不良反应信息的系统。由欧洲药品管理局(EMA)代表欧盟(EU)药品监管机构网络运营管理该系统。与EudraVigilance的对接意味着中国制药企业在欧盟开展的临床试验或上市后产品发生的不良反应个例报告都可以通过eSafety药物警戒系统(中文版和国际版)以E2B R3形式直接进行电子递交,满足境外法规的要求。

犹如开展所有药物警戒工作,药物警戒信息化系统的设计与优化必须基于对本国法规的深入研究与透彻理解。使用者应该意识到“中文界面不是中国版系统”,因为它无法解决中国的很多实际问题(如临床研究中的SAE递交,上市后的反馈数据)。
在太美医疗科技,有专门的团队深入研究各国法规、ICH E2B、欧盟GVP、信号检测等一切从事药物警戒工作所必备的知识,2018年,团队开始联系以严谨细致著称的欧洲监管机构,希望能够以系统服务商的身份和EudraVigilance进行对接测试,得到肯定的回复后,团队经历了数十个sample case的反复测试和研发技术攻关,eSafety系统与EudraVigilance成功对接。这些都是eSafety药物警戒系统国际版开发的坚实基础,让系统满足各国当地法规要求与操作实践,与业务流程高度融合。
最终,60%的努力在系统功能上,40%的工作是保证系统满足GXP的要求
与此同期,太美医疗科技于2019年4月完成了欧洲合作伙伴的现场审计,将eSafety(国际版)运用于国际临床研究和上市后药物警戒工作。审计过程中,太美医疗科技药物警戒业务专家为来自欧洲的药物警戒运营专家和质量专家现场演示eSafety(国际版)的操作流程,系统功能的完整性、规范性、灵活性和流畅的交互体验得到了合作伙伴的高度认可,完全达到了国际领先水平。审计所需的近6000页的符合GxP要求的软件验证文档也得到了审计专家的赞赏,原定3天的审计工作提前一天结束。

作为生命科学领域技术解决方案提供商,太美医疗科技在药物警戒领域拥有专业敏锐的洞察力和前沿的视角,强健的综合实力与敏捷的行动力,逐渐成为中国药物警戒的标杆。与此同时,随着国际化进程的加快,太美医疗科技药物警戒与法规合规事业部积极开展国际化业务的布局,开发eSafety药物警戒系统国际版,积极对接更多境外监管机构,熟知各国法规规范,承接海外药物警戒业务,助力中国制药企业走向国际,中国新药走向全球。